Почему открытие лекарств на основе малых молекул набирает обороты
Благодаря инновационным инструментам и методам в медицинской химии сейчас настало захватывающее время для создания новых лекарств.
По данным Drug Discovery and Development, в прошлом году продажи 10 самых продаваемых лекарств были разделены в соотношении 40:60 между небольшими молекулами и более крупными и сложными биологическими препаратами. Но эти цифры искажаются огромной стоимостью некоторых биологических блокбастеров. По данным исследования Medicine in Drug Discovery (2021 г., DOI: 10.1016/j.medidd.2020.100075), в глобальном масштабе около 90% всех продаваемых лекарств представляют собой небольшие молекулы.
Не так давно казалось, что эти низкомолекулярные препараты выходят из моды. Достижения в области биотехнологий позволили фармацевтическим компаниям экономически эффективно создавать ряд биологических препаратов, таких как крупные пептиды, рекомбинантные белки, моноклональные антитела, конъюгаты антитело-лекарственное средство, фьюжн-белки и вакцины.
Но органические соединения с низкой молекулярной массой — молекулы, которые можно вводить перорально и проходить через клеточные мембраны, достигая внутриклеточных мишеней, — уже более 100 лет являются основой фармацевтической промышленности.
И вместо того, чтобы исчезнуть, они продолжают оставаться важной частью терапевтического арсенала отрасли. За последние 10 лет или около того достижения в области технологий, синтетической методологии и биофармацевтических исследований открыли больше возможностей для инновационных и креативных низкомолекулярных лекарств.
Данные Управления по контролю за продуктами и лекарствами США (U.S. FDA) показывают, что малые молекулы продолжают играть жизненно важную роль в фармакопее. Из 293 новых химических веществ, одобренных FDA в 2017–2022 годах, 182 были низкомолекулярными лекарствами.
А разработчики лекарств изучают новые способы использования малых молекул для борьбы с болезнями. Традиционный подход к лечению многих заболеваний заключался в поиске молекулярного ключа, который мог бы поместиться внутри белка, блокируя часть его трехмерной формы и подавляя его активность. Вместо этого исследователи все чаще используют небольшие молекулы для ковалентного связывания с белками или для сближения белков друг с другом, чтобы они могли работать вместе.
Вместо того, чтобы терять свою привлекательность в современном мире биологических достижений, малые молекулы переживают своего рода ренессанс. Существует ажиотаж и ощущение, что медхимики могут разрабатывать решения для болезней, бороться с которыми раньше считалось невозможным.
НОВЫЕ СПОСОБЫ ДЕЙСТВИЯ
Многие химики согласились бы с возобновлением энтузиазма по поводу того, что могут сделать медхимики, даже если бы они не назвали это золотым веком. Кейт Хорнбергер, возглавляющий группу медхимиков в биотехнологической фирме Arvinas, говорит, что золотой век – неподходящее название. «Я бы сказал, что это новый век», — говорит он. Новые способы применения малых молекул никогда не рассматривались 20 лет назад и изменили представление о том, что химики называют лекарственными препаратами.
Самым большим изменением, по мнению экспертов, являются возможности, открывающиеся благодаря ковалентным ингибиторам и молекулам индуцированной близости, молекулам, которые выходят за рамки подхода «замок и ключ» для нацеливания на нежелательные белки.
Ковалентные лекарства могут захватывать реактивные аминокислоты в белках, даже если подходящего кармана или замочной скважины не существует. Одним из ярких примеров является работа Кевана Шоката из Калифорнийского университета в Сан-Франциско и его команды. В 2013 году группа Шоката нашла способ, как лекарство ковалентно связывается с цистеином у вызывающего рак мутанта KRas и ингибирует белок. Сегодня можно воздействовать не только на цистеины, но и на многие другие реактивные боковые цепи аминокислот.
А наиболее известными примерами нацеливания на индуцированную близость являются химеры, нацеленные на протеолиз, или PROTAC, впервые разработанные лабораторией Крейга Крюса в Йельском университете. Эти гибкие молекулы со связующими веществами на обоих концах могут объединять два белка в клетке и добавлять метки убиквитина, чтобы пометить интересующий белок на предмет деградации.
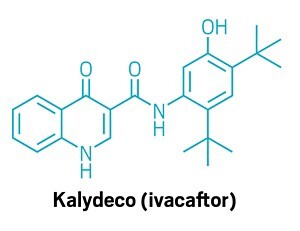
Состав Калидеко (ивакафтор). Ивакафтор помогает держать ионные каналы открытыми у людей с муковисцидозом.
С тех пор химики также расширили этот подход, создав множество вариантов. К ним относятся регулируемые химеры, нацеленные на близость (RIPTAC), которые удерживают, стабилизируют и ингибируют проблемные белки, а также химеры, нацеленные на лизосомы (LYTAC), которые специфически маркируют внеклеточные белки для разрушения. Эти молекулы объединяют белки, участвующие в раке, вызывая гибель клеток, или втягивают внеклеточные белки в клетку для разрушения. Химики теперь также могут создавать молекулы, которые испытывают различные посттрансляционные модификации, такие как деубиквитинирование, фосфорилирование и ацетилирование.
Эти длинные молекулы могут не выглядеть как низкомолекулярные лекарства прошлого, и у них нет характеристик, которые традиционно делают хорошие низкомолекулярные лекарства. Но клинические испытания показали, что молекулы могут проникать в клетки и эффективно лечить различные виды рака.
Ни один проект PROTAC еще не преодолел последние нормативные препятствия и не получил одобрения. Но эксперты говорят, что концепция индуцированной близости доказала неправоту скептиков и что появление такого препарата на рынке — лишь вопрос времени.
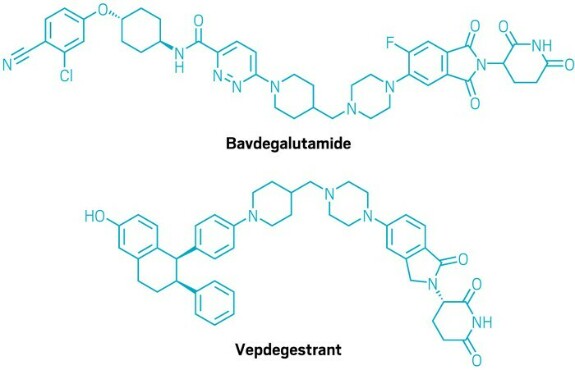
Подобные PROTAC от Arvinas содержат два связывающих мотива, соединенных линкером.
Между тем, молекулярные клеи — это меньшие способы вызвать деградацию с помощью убиквитинирования. Они работают, присоединяясь к одному белку, чтобы изменить его сродство к другому белку в клетке.
Фирмы, производящие молекулярный клей, сейчас подписывают соглашения с Big Pharma. Например, в прошлом году Proxygen подписала соглашения с Merck KGaA и Merck & Co. на разработку молекулярных клеев в качестве деструкторов. А последнее сотрудничество Monte Rosa Therapeutics с фармацевтической фирмой Roche направлено на разработку клеев против рака и неврологических заболеваний, которые раньше считались неизлечимыми.
Оглядываясь назад, говорит Хорнбергер, эти разработки стали результатом тщательной структурной работы таких биохимиков, как Шокат. Эта работа помогла медхимикам отойти от парадигмы «замка и ключа» ингибирования белков. Сегодня многие медхимики ищут различные способы изменить поведение белков.
«Если бы вы сказали медхимикам 15–20 лет назад, что мы будем заниматься химией в клетках, мы бы просто посмеялись над этим, но это то, что мы делаем», — говорит Джоэл Барриш, ветеран отрасли, ныне работающий в RA Capital Ventures. «Я имею в виду, что мы, по сути, берем под контроль естественные механизмы регулирования».
И целью воздействия могут быть не только белки. Ключевой областью исследований малых молекул является идентификация и разработка молекулярных объектов, способных нацеливаться на РНК. Долгое время считалось, что человеческая РНК не поддается воздействию лекарств, но теперь исследователи знают, что РНК принимает трехмерные структуры, которые обладают точками связывания, способными к взаимодействию с небольшими молекулами.
«Мое личное мнение таково, что следующим большим достижением станут нуклеиновые кислоты», — говорит Зои Уоллер, доцент кафедры открытия лекарств в Университетском колледже Лондона. «Нацеливание на нуклеиновые кислоты было узкоспециализированной областью, но сейчас оно действительно становится все более распространенным».
Одной из компаний, занимающихся связыванием РНК, является Arrakis Therapeutics, соучредителем которой является химик Дженнифер Петтер. Она говорит, что фирма работает над несколькими подходами к подавлению РНК, включая связывание регуляторного участка для непосредственной модификации биологии, индуцирование деградации РНК и даже ковалентное связывание полинуклеотида. «В наших стенах у нас фактически есть мультимодальный цех малых молекул», — говорит она.
МАЛЕНЬКИЙ…. НАСКОЛЬКО МАЛЕНЬКИЙ?
Но не все эти молекулы такие уж и маленькие :-)
Двадцать пять лет назад Кристофер А. Липински создал набор правил или рекомендаций для описания характеристик успешных малых молекул, которые можно принимать перорально. Названные «Правилом пяти», они были основаны на наблюдениях, что успешные кандидаты на лекарства часто имели массу менее 500 г/моль и были липофильными. Но не все лекарства, разрабатываемые медхимиками, соответствуют этим критериям.
Сегодня медхимики создают все более крупные молекулы. Названные молекулами, выходящим за рамки правила пяти, они могут включать в себя бифункциональные препараты, такие как PROTAC, а также гораздо более крупные молекулы, такие как циклические пептиды. «Так что же такое маленькое?» — спрашивает Бэрриш.
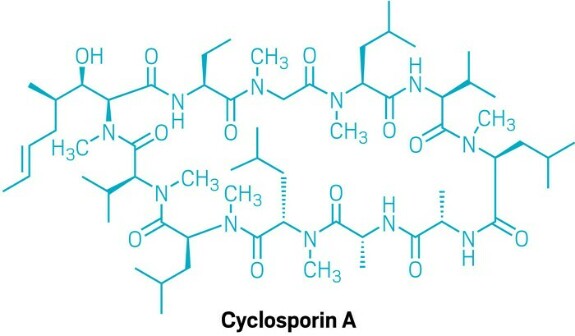
Иммунодепрессант циклоспорин А был одобрен в 1983 году, до того как Липински опубликовал свое «Правило пяти».
Мэтью Дисней — химик из Института биомедицинских инноваций и технологий имени Герберта Вертхайма У. Ф. Скриппса при Университете Флориды, основавший компанию Expansion Therapeutics для разработки небольших молекул, способных связываться со структурами РНК. Он заметил тенденцию к увеличению молекул. «Лекарства, одобренные FDA, становятся все больше в размерах», — говорит Дисней. «Промышленность публикует информацию в литературе, чтобы показать, что эти более крупные молекулы могут быть биодоступны при пероральном приеме — я думаю, это просто делает науку лучше для всех».
Разработка этих более крупных молекул требует медицинской химии. «Я не думаю, что можно создавать медицину без химиков-органиков. И как академических, так и промышленных», — говорит Дисней. «Вам нужны ученые, чтобы создавать новые методы, и промышленность, чтобы их применять. Помимо биохимиков, биоинформатиков и биологов вам нужны и синтетики».
По словам Мэтью Тодда, который реализует проекты в области медицинской химии с открытым исходным кодом в своей лаборатории в Университетском колледже Лондона, участвующим химикам нужны новые синтетические методы, которые можно было бы добавить в их наборы инструментов. Одной из таких разработок являются методы скелетного редактирования, которые могут перемещать атомы в молекулярные структуры и из них. Недавний пример может заменить углерод на азот в ароматическом кольце.
Эти новые синтетические инструменты дают медхимикам больше возможностей и могут помочь им создавать молекулы, которые, как было доказано, связываются с мишенью, но, возможно, не так хорошо. «Объединение этих факторов с преобладанием ковалентных молекул и преобладанием веществ-деструкторов открывает новые возможности», — говорит Тодд.
Петтер соглашается. «Если вы готовы заняться более крупными молекулами, это откроет возможность для действительно замечательных, инновационных молекулярных конструкций», — говорит она.
ТЕХНОЛОГИЧЕСКИЕ РАЗРАБОТКИ
Инсайдеры отрасли отмечают, что химики не добились бы таких успехов без достижений в биологии и приборостроении. «В целом это достижения науки», — говорит Барриш из RA Capital Ventures. «Именно достижения в области химии и технологий действительно позволяют нам получить доступ к [мишеням и биологии], чего мы не могли сделать раньше».
Эти технологические скачки начались в 1980-х годах с усовершенствований в структурной биологии, включая развитие криоэлектронной микроскопии и методов рентгеновской кристаллографии высокого разрешения, которые позволяют ученым визуализировать биологию чуть ли нет на атомном уровне. Но они также включают биоинформационные экраны и массивы, позволяющие искать места, где один белок может взаимодействовать с другим белком.
Генетический скрининг также помог усилиям медхимиков, обнаружив новые связи между генами и болезнями, чтобы драг-хантеры («охотники за лекарствами») могли успешно идентифицировать новые цели для лекарств. И неудивительно, что Петтер говорит, что улучшения в генетическом секвенировании очень помогли ее работе по разработке молекул, нацеленных на РНК.
Еще одним изменением стала экстернализация сервисов, таких как проектирование составных библиотек. Распространение контрактных исследовательских организаций и других сервисных фирм означает, что биотехнологии могут покупать необходимые им химические знания, а не разрабатывать их самостоятельно. И эти фирмы также могут стимулировать технологические инновации, например, создавая библиотеки кодирования ДНК или требуемые соединения.
Услуги этих фирм, производящих «молекулы по запросу», «действительно изменили ситуацию», говорит Тодд. «Мы изучили все молекулы, которые можно купить, и пытаемся придумать способы их расширения за счет синтеза новых основных строительных блоков, которые затем можно украсить другими вещами, которые можно купить».
Эти модульные строительные блоки и способы их компьютерного описания также побудили исследователей экспериментировать с тем, как использовать искусственный интеллект и машинное обучение для разработки новых лекарств. Исторически сложилось так, что вычислительные методы помогали охотникам за наркотиками и разработчикам моделировать новые низкомолекулярные терапевтические средства без необходимости их фактического синтеза. Эта тенденция продолжилась и в стартапах, основанных на искусственном интеллекте, которые полностью или частично сосредоточены на разработке низкомолекулярных лекарств.
Согласно отчету BiopharmaTrend, около 45% всех стартапов по поиску лекарств, которые используют или разрабатывают специализированные инструменты искусственного интеллекта, ориентированы на малые молекулы, и только около 24% работают над разработкой биологических лекарств. Аналогичные цифры касаются денежных средств, инвестируемых в эти фирмы венчурными капиталистами.
Никто не ожидает, что компьютеры заменят медхимиков, но многие ученые считают, что ИИ может им помочь. Несколько компаний по разработке лекарств с платформами на базе искусственного интеллекта недавно довели такие молекулы до клинических испытаний, иногда быстрее и дешевле, чем можно было бы ожидать при использовании других методов.
«Именно здесь возникает прекрасная возможность: у нас может быть ренессанс с лучшими малыми молекулами с появлением ИИ», — говорит профессор UCL Уоллер.
НО ТОЧНО ЛИ ЭТО ЗОЛОТОЙ ВЕК?
Сегодня малые молекулы могут делать многое из того же, что и биологические лекарства, и добиваться при этом финансового успеха. Например, среди препаратов, лечащих спинальную мышечную атрофию, есть Золгенсма, однократная инъекция генной терапии; Спинраза, олигонуклеотид, вводимый в виде инъекции в позвоночник каждые несколько месяцев; а с 2020 года ежедневный низкомолекулярный препарат Эврисди (рисдиплам) в виде раствора для перорального применения. Объем продаж Evrysdi в 2022 году превысил $1 млрд, а ее продажи в первой половине этого года выросли на 48% по сравнению с аналогичным периодом 2022 года, в то время как продажи Zolgensma и Spinraza упали.
Маленькие молекулы зачастую эффективны и дешевы, особенно после того, как на них перестает распространяться патент. И их может быть проще хранить и принимать пациенту, чем аналогичные биопрепараты. По мере того, как исследователи узнают больше о том, как болезни и лекарства действуют на молекулярном уровне, старые молекулы, механизмы которых, возможно, не были понятны при их первой разработке, могут снова стать полезными.
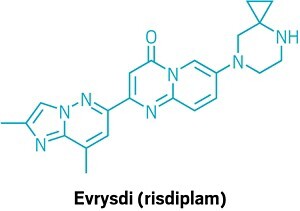
Строение Эврипида (рисдиплама).
Фармацевтической промышленности уже более 100 лет, и для многих настоящий золотой век открытия лекарств длился с 1940-х по 1970-е годы. Низкомолекулярные препараты той эпохи, такие как антидепрессанты, нейролептики и оральные контрацептивы, были поистине революционными. Вместо того, чтобы называть сегодняшний день золотым веком, химики используют разные термины: новый золотой век, новый век, ренессанс или обновление.
Предприниматель в области биотехнологий Итан Перлштейн, который пытается перепрофилировать существующие малые молекулы для лечения метаболических нарушений, утверждает, что золотой век никогда и не заканчивался — люди просто отвлекались на другие терапевтические методы. В исследованиях есть элемент моды, и «маленькие молекулы — ужасный термин для маркетинга», — говорит он.
А пока драг-хантеры («охотники за лекарствами») смотрят в свои хрустальные шары, маленькие молекулы по-прежнему являются ключевой частью медицинского арсенала. Но, возможно, внешний вид этих молекул будет меняться все больше и больше. «Я предполагаю, что появятся виды лекарств, которые покажутся нам странными, потому что они не похожи на то, что мы ожидаем», — говорит Уоллер. «И это то, что нам нужно... Там такой большой потенциал».